-
Compteur de contenus
2999 -
Inscription
-
Dernière visite
-
Jours gagnés
16
Type de contenu
Profils
Forums
Téléchargements
Blogs
Boutique
Calendrier
Noctua
Tout ce qui a été posté par fdudu
-

IC 1805 - Nébuleuse du Coeur à la TSAPO 80
fdudu a répondu à un sujet de Lespius dans Astrophotographie
Superbe image! Ça me fait d'autant plaisir que j'ai la même lunette. Cette lunette est un bonne instrument mais hélas je l’avais prévue avec un Day star pour le soleil en ha, projet qui ne c'est jamais concrétisé. Elle reste dans sa manlette depuis 5 ans sans jamais être utilisée. J'ai dû l'utiliser 5 x maximum. FRanck -
+1 Tout a fait d'accord avec toi
-
C'est superbe !
-
Soit le bienvenue sur le forum.
-
Bonjour Lune cendrée, Moi aussi j'étais passé à coté de ta nouvelle taka. En tous les cas, c'est du superbe matériel de premier ordre ! Amicalement, FRanck PS : bonne année 2025, en tout les cas elle commence bien avec cette superbe taka
-

Néb diff La nébuleuse de la tête de cheval depuis l'Australie et en SHO...
fdudu a répondu à un sujet de Guy53 dans Astrophotographie
Superbe image ! -
Magnifique photo !
-
Bonjour les ami(e)s, bonjour Charles, Vraiment sympa ta vidéo en lumière oblique 👍 Amitiés, FRanck
-
Résolution et netteté impressionnante !
-

Holoea la quête du Graal. (Infrarouge proche)
fdudu a répondu à un sujet de Ouki dans Observation en Visuel Assisté
Bien joué ! L'année commence bien. -
Bonne année 2025 les ami(e)s de wa
-
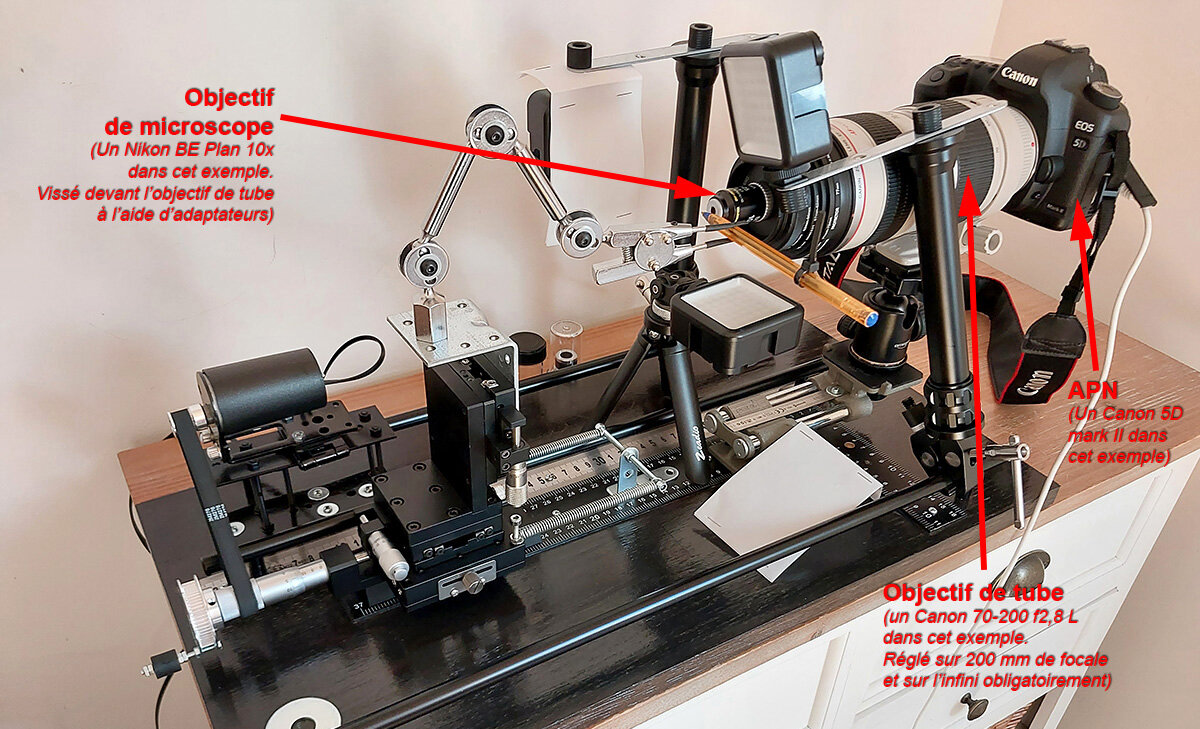
Bonjour les ami(e)s, J'espère que vous allez bien. Me revoici encore avec une araignée Zoropsis spinimana prise avec un objectif de microscope Mitutoyo M Plan apo 5x 0.14. Précision illustrée : ces objectifs de microscope sont conçus pour être mis devant des objectifs de tube d'une focale de 200 mm : Une autre précision avant de continuer : comme vous le savez certainement, pour un format de capteur aps-c, on ce retrouve avec un facteur de recadrage de 1,6 chez Canon par rapport à un capteur plein format. J'ai testé pour cette prise de vue un objectif de tube de 105 mm de focale. Je fais ce test car j'ai en prévision d'acquérir un Canon M6 markII qui est lui aussi avec un capteur aps-c mais qui a une résolution de dingue de 32,5 M/pixels ! Si j'avais utilisé un objectif de 200 mm de focale à la place de celui de 105 mm, j'aurais eu un champ plus restreint de 1,6x moins J'ai juste peur que la netteté soit moindre avec le Sigma 105 mm qu'avec l'excellent objectif Canon 70 200 f2.8 L mais je m'inquiète peut être pour rien. Image stackée à partir de 365 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif de tube Sigma 105 mm ouvert à f2.8 et réglé sur l'infini - APN Canon 1200D - temps de pose de 1/25 de seconde à 100 ISO L'araignée est poussiéreuse mais ce n'est pas grave pour ce test de netteté. J'ai besoin d'avis extérieurs, alors les ami(e)s, dite moi ce que vous en pensez sans ménagement au niveau du piqué. (J'ai appliqué exactement les mêmes réglages dans Photoshop CS6 que pour mes autres images au niveau de la post production - Pas de IA !) En passant, voici mon poste de "travail" : Amitiés, FRanck
-

Lune La Lune du vendredi 13 décembre 2024 premier essais d’empilement planétaire
fdudu a répondu à un sujet de lviatour dans Astrophotographie
Bonjour Luc, Ton site "lucnix.be" est très bien fait 👍 J'aime beaucoup. -
+1 Tes photos sont très réussies je trouve 👍
-

soleil A quoi ressemble le Soleil en ce moment
fdudu a répondu à un sujet de Newton dans L'actualité du ciel
Bonjour à tous, Ca fait du bien de parcourir ce fil avec ce temps de m.r.e En plus, vos photos sont vraiment bien réussies je trouve. Bravo ! Amicalement, FRanck -

Soleil Ejections et filament réfracteur 185 Askar 10/12/24
fdudu a répondu à un sujet de soleilrouge dans Astrophotographie
Superbes photos de notre étoile comme d'habitude 👍 -

Les Tetards et l'étoile flamboyante (mosaic 2 en 1)
fdudu a répondu à un sujet de Ant-1 dans Astrophotographie
C'est magnifique ! et en plus le champ est très immersif 👍 -
Bonjour les ami(e)s, Voici la version entièrement "nettoyée" des grains de poussière dans Photoshop avec principalement l'outil "Tampon de duplication" et l'outil "Goutte d'eau" pour estomper quand nécessaire les "traces" dues aux duplications de matière. Tout ça sans IA ! à l'ancienne avec la sourie, avec tout de même quelques poses Amitiés, FRanck
-
Bonjour les ami(e)s, Une autre version de la même araignée toujours au banc macro avec l'objectif Mitutoyo 5x mais hélas très poussiéreuse. Comme un idiot ! je l'ai fait tomber par terre. Dans Photoshop, J'ai pu enlever les poussières qu'il y avait dans les yeux mais je n'ai pas eu le courage et ni le temps de le faire sur toute l'araignée. J'essaierais de la nettoyer dans de l'acétone mais je ne suis pas sûr du résultat. On verra bien. Prise de vue : Image stackée à partir de 348 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Canon 70 200 L f2.8 ouvert à f2.8 et réglé sur l'infini - temps de pose de 1/8 de seconde à 400 ISO Amitiés, FRanck
-
Bonjour les ami(e)s, Une autre version de la même araignée toujours au banc macro avec l'objectif Mitutoyo 5x. Image stackée à partir de 177 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Canon 70 200 L f2.8 ouvert à f2.8 et réglé sur l'infini - temps de pose de 1/20 de seconde à 200 ISO Amitiés, FRanck
-
Bonjour les ami(e)s, Revoici ma "beautée" au banc macro avec l'objectif Mitutoyo 5x. Prise de vue : Image stackée à partir de 233 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Canon 70 200 L f2.8 ouvert à f2.8 et réglé sur l'infini - temps de pose de 1/20 de seconde à 200 ISO Je l'ai posé sur un bout de feuille Canson blanche mais je ne recommencerais plus car si l'on regarde dans les yeux (t'as beau yeux tu sais ), on voit par reflet la feuille de Canson sur la moitié des yeux et ça fait bizarre. On voit aussi par reflet ses pattes de devant, les lampes led et le bout de l'objectif. Ca va être "chaud" de trouver un moyen de corriger tout ça lors de la prise vue car en post production dans Photoshop, c'est juste très très compliqué et je pense que même si il existe une astuce pour la correction (peut être avec le tampon de duplication ? ) ça se verra. Amitiés, FRanck
-

Première Saturne de la saison 2024 avec Doctelescope 460mm 😊!
fdudu a répondu à un sujet de HAlfie dans Astrophotographie
+1 -
Bonjour les ami(e)s J'espère que allez toujours bien. Je vous partage une autre araignée que je pense être une Platycryptus undatus (décidément, elle se sont données rendez-vous chez moi; elle rentrent à l'intérieur certainement à cause du froid je pense). Je l'ai prise pour l'instant en macro "standard" (taux de 1/1) avec un objectif Sigma 105mm macro et un Canon 1200D. Prises de vue : De face : Image stackée à partir de 29 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Sigma ouvert à f5.6 - temps de pose de 1/400 de seconde à 100 ISO De 3/4 : Image stackée à partir de 40 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Sigma ouvert à f5.6 - temps de pose de 1/400 de seconde à 100 ISO De coté : Image stackée à partir de 46 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Sigma ouvert à f5.6 - temps de pose de 1/400 de seconde à 100 ISO De derrière : Image stackée à partir de 41 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Sigma ouvert à f5.6 - temps de pose de 1/400 de seconde à 100 ISO De dessus : prise de vue : Image stackée à partir de 21 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif Sigma ouvert à f5.6 - temps de pose de 1/400 de seconde à 100 ISO Je pense que je vais peut être (question de temps) continuer à prendre cette "beautée" au banc macro et au microscope. Amicalement, FRanck
-
Bonjour les ami(e)s, J'espère que vous allez tous bien. Je vous partage une zoropsis spinamana zoropse à pattes épineuses prise sur banc macro avec les objectifs Mitutoyo M Plan Apo 5x et 10x avec un objectif de tube Sigma 105 mm macro, le tout sur un Canon 1200D. Prises de vue : Avec l'objectif Mitutoyo 5x : Image stackée à partir de 177 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif de tube Sigma ouvert à f2.8 et réglé sur l'infini - temps de pose de 1/30 de seconde à 100 ISO Avec l'objectif Mitutoyo 10x : Image stackée à partir de 189 images dans HeliconFocus avec la méthode C et lissage à 1 - objectif de tube Sigma ouvert à f2.8, temps de pose de 1/20 de seconde à 100 ISO Je précise que l'objectif de tube utilisé est un Sigma de 105 mm de focale et que les objectifs Mitutoyo ont été conçus pour être utilisés avec un objectif de tube d'une distance focale de 200 mm. Par conséquent les taux de grandissement de 5x et 10x ne sont effectifs qu'avec cette focale de 200 mm. Il faut donc diviser par à peu près 2 les taux de grandissement. Mais vu que l'appareil photo utilisé est un APS-C Canon 1200D, il faut également, ce coup-ci, multiplier par le "facteur de recadrage" qui est de 1,6 x pour les Canon. Pour le 5x, le taux de grandissement est donc de 4x (5/2 x 1.6) - Pour le 10x, le taux de grandissement est donc de 8x (10/2 x 1.6) Amitiés, FRanck